ในทางเคมี ธาตุ คือ สารบริสุทธิ์ซึ่งประกอบด้วยอนุภาคมูลฐานเลขอะตอม อันเป็นจำนวนของโปรตอนในนิวเคลียสของธาตุนั้น ตัวอย่างธาตุที่คุ้นเคยกัน เช่น คาร์บอน ออกซิเจน อะลูมิเนียม เหล็ก ทองแดง ทองคำ ปรอทและตะกั่ว
จนถึงเดือนพฤษภาคม พ.ศ. 2554 มีการบ่งชี้ธาตุแล้ว 118 ธาตุ ล่าสุดคือ ออกาเนสซอน ใน พ.ศ. 2545[1] ในบรรดาธาตุที่รู้จักกัน 118 ธาตุนั้น มีเพียง 94 ธาตุแรกเท่านั้นที่เชื่อกันว่าเกิดขึ้นเองตามธรรมชาติบนโลก และมี 80 ธาตุที่เสถียรหรือโดยพื้นฐานแล้วเสถียร ขณะที่ที่เหลือเป็นธาตุกัมมันตรังสี ซึ่งจะสลายตัวไปเป็นธาตุที่เบากว่าในระยะเวลาที่แตกต่างกันจากเสี้ยววินาทีไปจนถึงหลายพันล้านปี ธาตุใหม่ ๆ ซึ่งมีเลขอะตอมสูงกว่าที่มีอยู่ตามธรรมชาติ สังเคราะห์ขึ้นจากผลิตภัณฑ์ของปฏิกิริยานิวเคลียร์
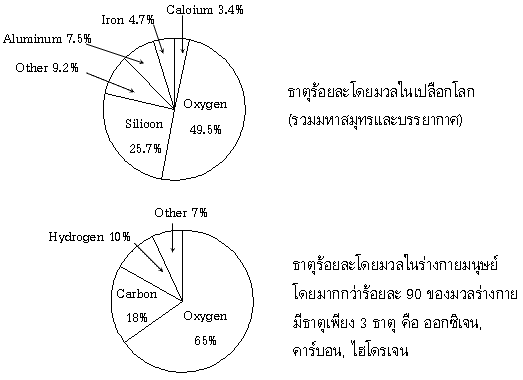
ไฮโดรเจนและฮีเลียมเป็นธาตุที่พบได้มากที่สุดในเอกภพ อย่างไรก็ดี ออกซิเจนเป็นธาตุที่พบได้มากที่สุดในเปลือกโลก ประกอบกันเป็นครึ่งหนึ่งของมวลทั้งหมด[2] แม้สสารเคมีทั้งหมดที่ทราบกันจะประกอบด้วยธาตุอันหลากหลายเหล่านี้ แต่สสารเคมีนั้นประกอบกันขึ้นเป็นเพียงราวร้อยละ 15 ของสสารทั้งหมดในเอกภพ ส่วนที่เหลือนั้นเป็นสสารมืด ซึ่งมิได้ประกอบด้วยธาตุเคมีที่มนุษย์รู้จัก เพราะไม่มีโปรตอน นิวตรอนหรืออิเล็กตรอน
เชื่อกันว่าธาตุเคมีเกิดขึ้นจากกระบวนการของเอกภพหลายอย่าง รวมทั้งไฮโดรเจน ฮีเลียม และลิเทียม เบริลเลียมและโบรอนปริมาณน้อยกว่า เกิดขึ้นระหว่างบิกแบงและปฏิกิริยาการแตกเป็นเสี่ยงของรังสีคอสมิก (cosmic-ray spallation) การเกิดขึ้นของธาตุที่หนักขึ้นตั้งแต่คาร์บอนไปจนถึงธาตุที่หนักที่สุดนั้นเป็นผลจากการสังเคราะห์นิวเคลียสของดาวฤกษ์ และมหานวดาราได้ทำให้ธาตุเหล่านี้มีสำหรับระบบสุริยะเนบิวลาและการก่อตัวของดาวเคราะห์ และเหตุการณ์ของเอกภพซึ่งทำให้เกิดการเปลี่ยนแปลงอื่น ๆ ซึ่งระเบิดธาตุที่สร้างขึ้นใหม่เหล่านี้จากดาวฤกษ์ออกสู่อวกาศ[3] ขณะที่ธาตุส่วนใหญ่มักถูกมองว่าเสถียร แต่การแปรนิวเคลียส (nuclear transformation) ตามธรรมชาติของธาตุหนึ่งเป็นอีกธาตุหนึ่งนั้นยังดำเนินอยู่ในปัจจุบัน โดยการสลายตัวของธาตุกัมมันตรังสี เช่นเดียวกับกระบวนการนิวเคลียร์อื่น ๆ เช่น การยิงรังสีคอสมิกและนิวเคลียร์ฟิชชันตามธรรมชาติของนิวเคลียสธาตุหนักหลายชนิด
เมื่อธาตุแตกต่างกันสองธาตุรวมตัวกันทางเคมี โดยมีอะตอมยึดเข้าด้วยกันด้วยพันธะเคมี ผลที่ได้เรียกว่า สารประกอบเคมี สองในสามของธาตุเคมีที่พบได้บนโลกพบเฉพาะในรูปของสารประกอบ และในหลายกรณี หนึ่งในสามที่เหลือนั้นก็มักพบเป็นสารประกอบเป็นส่วนใหญ่ สารประกอบเคมีอาจประกอบด้วยธาตุที่รวมเข้าด้วยกันในสัดส่วนจำนวนเต็มแน่นอน ดังเช่น น้ำ เกลือแกง และแร่ อย่างควอตซ์ แคลไซต์ และแร่โลหะบางชนิด อย่างไรก็ดี พันธะเคมีของธาตุหลายประเภทส่งผลให้เกิดเป็นของแข็งผลึกและอัลลอยโลหะ ซึ่งไม่มีสูตรเคมีแน่นอน สสารของแข็งส่วนใหญ่บนโลกเป็นประเภทหลังนี้ คือ อะตอมก่อเป็นสสารของเปลือกโลก แมนเทิล และแก่นโลกชั้นในก่อสารประกอบเคมีที่มีองค์ประกอบหลากหลาย แต่ไม่มีสูตรเอมพิริคัลแน่ชัด
ในการนำเสนอเหล่านี้ทั้งหมด คุณสมบัติทางกายภาพและทางเคมีของธาตุบริสุทธิ์แต่ละธาตุนั้นไม่ชัดเจน ซึ่งเป็นเช่นนั้นแม้ธาตุที่เกิดในรูปไม่ผสม หากธาตุเหล่านี้เกิดเป็นสารผสม ซึ่งส่วนใหญ่เป็น ขณะที่ธาตุที่เกิดขึ้นเองตามธรรมชาติทั้งหมด 94 ธาตุ จะได้รับการบ่งชี้ในตัวอย่างแร่จากเปลือกโลก มีเพียงธาตุส่วนน้อยพบเป็นแร่ค่อนข้างบริสุทธิ์ที่สามารถรู้ได้ ส่วน "ธาตุธรรมชาติ" ที่หาพบได้ง่ายกว่า เช่น ทองแดง เงิน ทองคำ คาร์บอน (ในรูปถ่านหิน แกรไฟต์ หรือเพชร) กำมะถันและปรอท ธาตุเฉื่อยแทบทั้งหมด เช่น แก๊สเฉื่อยและโลหะมีตระกูล มักพบบนโลกในรูปผสมทางเคมี เป็น สารประกอบเคมี ขณะที่ธาตุเคมีราว 32 ธาตุ พบบนโลกในรูปไม่ผสมตามธรรมชาติ แต่ธาตุเหล่านี้หลายชนิดเกิดเป็นสารผสม ตัวอย่างเช่น อากาศชั้นบรรยากาศส่วนใหญ่เป็นสารผสมไนโตรเจน ออกซิเจนและอาร์กอน ธาตุของแข็งตามธรรมชาติยังมักเกิดเป็นสารผสมหลายชนิด เช่น อัลลอยของเหล็กและนิกเกิล
ประวัติศาสตร์การค้นพบและการใช้ธาตุเคมีเริ่มขึ้นด้วยสังคมมนุษย์ยุคแรกเริ่มที่พบธาตุธรรมชาติอย่างทองแดงหรือทองคำ และสกัด (หลอม) เหล็กและโลหะอื่นบางชนิดจากแร่โลหะนั้น นักเล่นแร่แปรธาตุและนักเคมีภายหลังบ่งชี้ธาตุเพิ่มขึ้นอีกมาก ซึ่งธาตุที่เกิดขึ้นเองตามธรรมชาติเกือบทั้งหมดเป็นที่ทราบกันใน ค.ศ. 1900 คุณสมบัติของธาตุเคมีมักสรุปโดยใช้ตารางธาตุ ซึ่งจัดธาตุเรียงตามเลขอะตอม แบ่งเป็นแถว ("คาบ") ซึ่งธาตุที่อยู่ในคอลัมน์ ("หมู่") เดียวกันจะมีคุณสมบัติทางกายภาพและทางเคมีเกิดเวียนซ้ำ เกือบทุกธาตุมีประโยชน์ใช้งานสำคัญต่อมนุษย์อย่างน้อยหนึ่งอย่าง ซึ่งอาจอยู่ในรูปบริสุทธิ์หรืออยู่ในสารประกอบเคมีหรือสารผสมหลายชนิด ยกเว้นธาตุกัมมันตรังสีที่มีครึ่งชีวิตสั้น ธาตุทั้งหมดหลังยูเรเนียม และรวมไปถึงอะเมริเซียม ปัจจุบันมีผลิตเป็นอุตสาหกรรม ซึ่งส่วนใหญ่มีความบริสุทธิ์สูง
ประมาณยี่สิบสี่ธาตุมีความสำคัญต่อสิ่งมีชีวิตหลายชนิด ธาตุหายากส่วนใหญ่บนโลกไม่จำเป็นต่อการดำรงชีวิต (ยกเว้น เซเลเนียมหรือไอโอดีน) ขณะที่ธาตุส่วนน้อยที่พบได้ค่อนข้างทั่วไป (อะลูมิเนียมและไทเทเนียม) ไม่จำเป็น สิ่งมีชีวิตส่วนใหญ่มีความต้องการธาตุร่วมกัน แต่มีความแตกต่างเล็กน้อยระหว่างพืชและสัตว์ ตัวอย่างเช่น สาหร่ายมหาสมุทรใช้โบรมีน แต่พืชบกและสัตว์ดูเหมือนไม่ต้องการเลย สัตว์ทุกชนิดต้องการโซเดียม แต่พืชบางชนิดไม่ต้องการ พืชต้องการโบรอนและซิลิกอน แต่สัตว์ไม่ต้องการหรืออาจต้องการในปริมาณเล็กน้อยมาก) มีเพียงหกธาตุ ได้แก่ คาร์บอน ไฮโดรเจน ไนโตรเจน แคลเซียม และฟอสฟอรัส ประกอบกันขึ้นเป็นเกือบ 99% ของมวลร่างกายมนุษย์ นอกเหนือไปจากหกธาตุหลักซึ่งประกอบเป็นร่างกายมนุษย์ส่วนใหญ่นั้น มนุษย์ยังต้องการบริโภคธาตุอีกอย่างน้อยสิบสองธาตุ
ชื่อธาตุแบ่งตามหมู่
- หมู่ 1A ลิเทียม (Lithium) โซเดียม (Sodium -Natrium) โพแทสเซียม (Potassium – Kalium) รูบิเดียม (Rubidium) ซีเซียม (Cesium) แฟรนเซียม(Francium)
- หมู่ 2Aเบริลเลียม (Beryllium) แมกนีเซียม (Magnesium)แคลเซียม (Calcium) สตรอนเชียม (Strontium) แบเรียม (Barium) เรเดียม (Radium)
- หมู่ 3A โบรอน (Boron) อะลูมิเนียม (Aluminum) แกลเลียม (Gallium) อินเดียม (Indium) แทลเลียม (Thallium)
- หมู่ 4A คาร์บอน (Carbon) ซิลิกอน (Silicon) เจอร์เมเนียม (Germanium) ดีบุก (Tin -Stannum) ตะกั่ว (Lead – Plumbum)
- หมู่ 5A ไนโตรเจน (Nitrogen) ฟอสฟอรัส (Phosphorous) อะซินิค (สารหนู) (Arsenic) พลวง (Antimony -Stibium) บิสมัท (Bismuth)
- หมู่ 6A ออกซิเจน (Oxygen) ซัลเฟอร์ (กำมะถัน) (Sulfur)ซีลีเนียม (Selenium) เทลลูเรียม (Tellurium) พอโลเนียม (Polonium)
- หมู่ 7A ฟลูออรีน (Fluorine) คลอรีน (Chlorine) โบรมีน (Bromine) ไอโอดีน (Iodine) แอสทาทีน (Astatine)
- หมู่ 8A ฮีเลียม (Helium) นีออน (Neon) อาร์กอน (Argon) คริปตอน (Krypton) ซีนอน (Xenon) เรดอน (Radon)
ยกเว้นไฮโดรเจน เพราะยังถกเถียงกันอยู่ว่าจะจัดลงไปที่หมู่ 1 หรือ 7 ดี เพราะคุณสมบัติเป็นกึ่ง ๆ กัน ระหว่าง 1A กับ 7A และธาตุประเภททรานซิชัน
แหล่งกำเนิดของธาตุในจักรวาล
1. ไฮโดรเจนและฮีเลียมเกิดเริ่มแรกในจักรวาลหลังบิกแบง
2. ธาตุตัวที่ 3 คือลิเทียม ถึงตัวที่ 26 คือเหล็กเกิดจากภาวะอัดแน่นในดวงดาว
3. ธาตุตัวที่หนักกว่าเหล็กจนถึงยูเรเนียมเกิดจากดาวระเบิดหรือปรากฏการณ์ นิวเคลียร์ฟิวชั่นในดาวฤกษ์ (กรณีหลัง จะได้กัมมันตภาพรังสีเป็นส่วนมาก)
สารประกอบ (Compound) เป็นสารบริสุทธิ์ที่ประกอบด้วยอะตอมของธาตุตั้งแต่ 2 ชนิดขึ้นไปมารวมกัน ด้วยแรงยึดเหนี่ยวทางเคมี เกิดเป็นสารชนิดใหม่ เรียกว่าสารประกอบ
ดังนั้นหน่วยย่อยของสารประกอบคือ โมเลกุล ซึ่งอาจแยกสลายได้เมื่อได้รับความร้อนหรือพลังงานไฟฟ้า สารประกอบที่พบในชีวิตประจำวัน เช่น น้ำ (H2O) เกลือแกง (NaCl) น้ำตาลทราย (C12H22O11) น้ำตาลกลูโคส (C6H12O6) เอทานอล (C2H5OH) คาร์บอนไดออกไซด์ (CO2) หินปูน (CaCO3) ด่างทับทิม (KMnO4) เป็นต้น
- โปรตอน (Proton) มีคุณสมบัติทางไฟฟ้าเป็นประจุบวก
- อิเล็กตรอน (Electron) มีคุณสมบัติทางไฟฟ้าเป็นประจุลบ
- นิวตรอน (Neutron) ไม่มีคุณสมบัติเป็นประจุ
- ธาตุลำดับที่ 1 คือ ไฮโดรเจน อะตอมของธาตุไฮโดรเจน ประกอบด้วย โปรตอน 1 ตัว และอิเล็กตรอน 1 ตัว และไม่มีนิวตรอน
- ธาตุลำดับที่ 2 คือ ฮีเลียม อะตอมของธาตุฮีเลียม ประกอบด้วย โปรตอน 2 ตัว นิวตรอน 2 ตัว และอิเล็กตรอน 2 ตัว
- ธาตุลำดับที่ 8 คือ ออกซิเจน อะตอมของธาตุออกซิเจน ประกอบด้วย โปรตอน 8 ตัว นิวตรอน 8 ตัว และอิเล็กตรอน 8 ตัว ดังภาพที่ 1
ภาพที่ 1 อะตอมของออกซิเจน
ตารางที่ 1 ธาตุที่มีอยู่มากบนเปลือกโลก
| ธาตุ | สัญลักษณ์ | % โดนน้ำหนัก | % โดนปริมาตร | % โดยจำนวนอะตอม |
| ออกซิเจน | O | 46.6 | 93.8 | 60.8 |
| ซิลิกอน | Si | 27.7 | 0.9 | 20.5 |
| อะลูมิเนียม | Al | 8.1 | 0.8 | 6.2 |
| เหล็ก | Fe | 5.0 | 0.5 | 1.9 |
| แคลเซียม | Ca | 3.6 | 1.0 | 1.9 |
| โซเดียม | Na | 2.8 | 1.2 | 2.5 |
| โปแตสเซียม | K | 2.6 | 1.5 | 1.8 |
| แมกนีเซียม | Mg | 2.1 | 0.3 | 1.4 |
| ธาตุอื่นๆ | - | 1.5 | - | 3.3 |
โมเลกุล (Molecule) คือเซ็ตการจับกลุ่มของอะตอม เมื่ออะตอมของธาตุออกซิเจนจับคู่กัน เราเรียกว่า ออกซิเจน (O2) มีคุณสมบัติเป็นแก๊สที่ช่วยให้ไฟติด แต่เมื่ออะตอมของธาตุออกซิเจนจับกลุ่มสามอะตอม เราเรียกว่า โอโซน (O3) มีคุณสมบัติเป็นแก๊สเรือนกระจก โมเลกุลอาจจะเป็นการจับคู่ของอะตอมต่างชนิดก็ได้ เช่น โมเลกุลของน้ำ (H2O) ประกอบด้วย อะตอมของไฮโดรเจน 1 ตัว และอะตอมของออกซิเจน 1 ตัว ทั้งนี้อะตอมของธาตุทั้งหลายสามารถเชื่อมต่อกันด้วยพันธะ 4 ชนิด ดังนี้
พันธะไอออน (Ion bond) เกิดขึ้นเมื่ออะตอมที่มีประจุบวกจับคู่กับอะตอมที่มีปะจุลบ เช่น เกลือโซเดียมคลอไลน์ (NaCl) ประกอบด้วย โซเดียมประจุบวก และคลอรีนประจุลบ ดังภาพที่ 2
ภาพที่ 2 โมเลกุลของโซเดียมคลอไรด์
พันธะโควาเลนต์ (Covalent bond) เกิดขึ้นเมื่ออะตอมเชื่อมต่อโดยการใช้อิเล็คตรอนร่วมกัน เช่น เพชร มีโครงสร้างที่เป็นอะตอมของธาตุคาร์บอนที่เชื่อมต่อกันเป็นรูปผลึกโดยใช้อิเล็กตรอนชั้นนอกร่วมกัน จึงมีความแข็งแรงมาก
พันธะโลหะ (Metallic bond) เกิดขึ้นกับอะตอมที่มีอิเล็กตรอนอยู่หลวมๆ นิวเคลียสของแต่ละอะตอมจะอยู่ชิดติดกัน แต่อิเล็กตรอนจะลื่นไหลส่งผ่านกันโดยอิสระ โลหะจึงมีความเหนียวและเหนี่ยวนำไฟฟ้าได้ดี
พันธะแวนเดอวาลส์ (Van der Waal's bond) เป็นพันธะที่ยึดแต่ละโมเลกุลไว้ด้วยกัน โดยมีจุดต่อเชื่อมที่อะตอมเพียงบางตัวซี่งยึดเหนี่ยวกันด้วยประจุต่างขั้ว พันธะแบบนี้จึงมีความแข็งแรงน้อย ยกตัวอย่างเช่น กราไฟต์ หรือไมกา ซึ่งสามารถดึงให้หลุดเป็นแผ่นได้โดยง่าย พันธะไฮโดรเจน เป็นรูปแบบหนึ่งของพันธะแวนเดอวาลส์ ซึ่งทำให้เกิดผลึกของน้ำแข็ง




ไม่มีความคิดเห็น:
แสดงความคิดเห็น